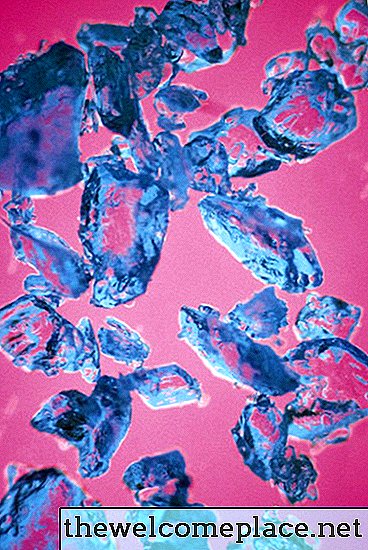
Zoals vele overgangsmetaalcomplexen is koper (II) sulfaatpentahydraat helder gekleurd; kristallen van deze prachtige substantie zijn een bleke schaduw van blauw. De kleur komt voort uit de chemie en de fysica van de samenstelling - of, meer specifiek, het soort verbindingen dat het vormt met de sulfaationen en watermoleculen die aan het koper zijn bevestigd.
 Kopersulfaatpentahydraat heeft een mooie doorschijnende blauwe kleur.
Kopersulfaatpentahydraat heeft een mooie doorschijnende blauwe kleur.Orbitalen
Elektronen vertonen dualiteit van golfdeeltjes, wat betekent dat ze zowel golfachtige eigenschappen als deeltjesachtige eigenschappen hebben. Het gedrag van een elektron in een atoom wordt beschreven door een golfachtige vergelijking die een golffunctie wordt genoemd. Het kwadraat van de golffunctie geeft de waarschijnlijkheid dat het elektron op een bepaald punt op een bepaald tijdstip zal worden gevonden. De golffuncties van elektronen in atomen worden ook atomaire orbitalen genoemd. Chemici noemen atomaire orbitalen door een getal te gebruiken om het energieniveau van de omloop aan te geven, gevolgd door een letter om het type omloop aan te geven. Voor elementen in de vierde periode van het periodiek systeem of hoger hoeft u zich alleen te concentreren op drie soorten orbitalen, namelijk s, p en d. Zie de link in de sectie bronnen om een idee te krijgen van de vorm van deze orbitalen.
Crystal Field Splitsen
Het koperion in koper (II) sulfaat heeft twee elektronen verloren, dus het heeft een +2 lading. Het heeft negen elektronen in zijn buitenste energieniveau of schaal; deze zogenaamde valentie-elektronen bezetten allemaal 3D-orbitalen. De watermoleculen en sulfaationen worden aangetrokken door de positieve lading op het koperion, dus ze benaderen het en schikken eromheen in een octaedrische configuratie. Bijgevolg liggen twee van de vijf 3d orbitalen van het koperion langs de assen waarmee de sulfaationen en watermoleculen naderen; aangezien de elektronen in deze orbitalen en de elektronen in de moleculen / ionen beide een negatieve lading hebben, stoten ze elkaar af. Uiteindelijk hebben twee van de vijf 3d orbitalen meer energie gekregen; deze worden bijvoorbeeld de orbitalen genoemd. De andere drie daarentegen hebben een verminderde energie en worden de t2g-orbitalen genoemd.
Absorptie van licht
Een foton van licht zal worden geabsorbeerd door het coördinatiecomplex als het een energie heeft die equivalent is aan het verschil tussen de toestand die een elektron nu inneemt en de energie van een andere staat waarover hij beschikt. Bijgevolg kan het kopersulfaatcomplex fotonen van licht absorberen met energieën die equivalent zijn aan het verschil in energie tussen t2g en bijvoorbeeld orbitalen. Het verschil in energie voor het kopersulfaatcomplex is namelijk gelijk aan het verschil in energie voor fotonen van licht in het rood-oranje gebied van het spectrum. Omdat roodachtig licht wordt geabsorbeerd terwijl blauw licht wordt doorgelaten, lijkt het kopersulfaat blauw.
Oplossen in water
Wanneer het kopersulfaat in water oplost, dissociëren de koper- en sulfaationen. Nu vormt het koperion een octaëdrisch complex waar het wordt omringd door zes moleculen water. Het effect is echter nog steeds vrijwel hetzelfde, omdat de splitsing tussen t2g-orbitalen en bijvoorbeeld orbitalen in dit nieuwe complex nog steeds zodanig is dat roodachtig oranje licht wordt geabsorbeerd en u een blauwkleurige oplossing ziet.